azasugars


早乙女周子、蟹江治
はじめに
多細胞生物の細胞表面は、糖脂質、糖タンパク質として存在する多様な糖鎖により覆われています。それらの構造や特定の糖鎖の比率は、発生段階、分化、がん化等により変化することも良く知られています。このようなことから私たち多細胞生物の営みにおいて糖鎖が大変重要な役割を果たしていることが示唆されています。また、細胞表面および細胞外に放出されるタンパク質のほとんどは糖鎖によって修飾されていて、ポストプロテオミクスとしてのグライコミクス研究が脚光を浴びつつあります。 糖鎖は数多くの糖加水分解酵素や糖転移酵素の連続的な反応によって合成されています。それら糖鎖の機能を詳細に研究するためには、糖転移酵素遺伝子のノックアウトを作成する方法が主流となっていますが、複数遺伝子のノックアウトは非常に困難である等の問題点もあります。これに変わる方法として特異的な酵素阻害剤を利用してタンパク質レベルでの機能阻害を行う方法も考えることができます。糖鎖関連酵素阻害剤としては、天然由来のアルカロイドが有効であることが既に多く知られていますが、糖鎖機能研究においてはさらに多くの機能的にオルトゴナルな(阻害能が交差しない)阻害物質群が必要です。
本稿では、私達のアプローチのコンセプトについて説明します。
1.五員環アザ糖への選択性の付与
糖鎖の生合成に関与する糖加水分解酵素及び糖転移酵素は、共に環の酸素に正の電荷が片寄った半イス型のオキソカルベニウムイオンを経由して反応が進行すると考えられています1-4) (図1)。
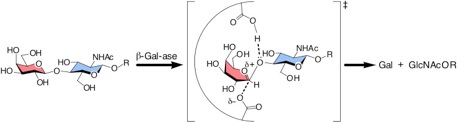
図1 糖加水分解酵素反応
β-ガラクトシダーゼの反応機構において予想される遷移状態。脱離していくプロトネートしたアグリコン残基と塩基に挟まれてアノメリック位炭素がsp2様の五価となっている。この時環酸素の非共有電子対が非局在化し炭素陽イオンの安定化に寄与する。
環の酸素を窒素に置換した五員環アザ糖類は、この反応中間体オキソカルベニウムイオンの擬似化合物と考えられ、糖関連酵素阻害剤研究において重要な位置を占めています。このような化合物は糖加水分解酵素の阻害剤となりますが、一般的には酵素特異性が低いことが知られています。その理由は、1)五員環化合物が多くの配座異性体を取りうること、2)ターゲットとなる酵素の基質である糖が一般に六員環であるのに対し五員環の水酸基の対応関係が曖昧となることにあると考えられます。
一方、側鎖の立体配置や導入する官能基等により特異性と阻害能の増強が可能であることが示されました5)(図2)。
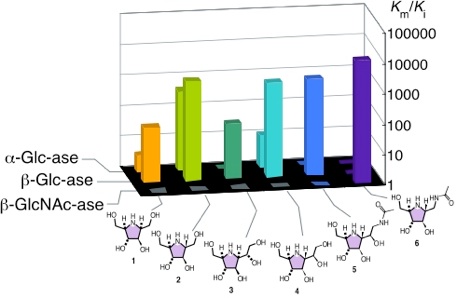
図2 グルコ型アザ糖の阻害作用
アノメリック位に相当する位置の立体、側鎖長、および、官能基の位置によりグルコ型アザ糖の様々な酵素に対する選択性が変化する。
例えば、対応する側鎖部分の立体配置の異なる化合物1と2あるいは3と4のα及びβグルコシダーゼに対する阻害活性を比較してみると、2、4において両酵素に対する阻害能の増強(10〜100倍)が見られます。この理由は、C-2位側鎖の立体が五員環の立体配座に及ぼす影響によると考えらることができます。すなわち、化合物2、4において「グルコ型」配座が優先していると考えられるわけです。さらに、炭素鎖長に注目してみると、化合物1、2に比べ3、4ではα-グルコシダーゼに対する阻害能のみが減弱しています。このことは、アグリコン部分に嵩高い置換基を導入すればβ-グルコシダーゼに対して選択性の高い酵素阻害剤を導くことができることを示唆しています。事実、側鎖末端にアセタミド基を導入した化合物5は、β-グルコシダーゼ(sweet almond)選択的な阻害剤となります(Km/Ki=1,455)。また、この化合物はβ-ヘキソサミニダーゼ(human placenta A)に対して極めて弱い阻害能しか持ちませんが、炭素鎖の短い化合物6は、この酵素に特異的かつ強力な阻害剤となることも判明しました(Km/Ki=11,364)。このように、側鎖をR-配置で導入することにより、「正しい」五員環の配座(グルコ型)が導かれただけでなく、その構造を変化させることによって酵素に対する選択性を導くことを達成することができました。
2.配座異性体の利用と選択性
五員環は様々な立体配座を取りえるため、アザ糖骨格水酸基の立体配置を適宜選択することによって、1つの骨格で複数の酵素をターゲットとすることができると考えられます。すなわち、2R,3R,4S,5R-配置のアザ糖(7)はガラクト型だけでなくマンノ型の擬似化合物ともなるような立体配座をもとる可能性があるわけです(図3)。
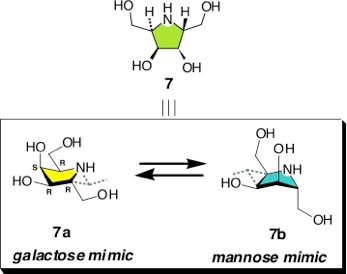
図3 ガラクト型およびマンノ型立体配座を取り得るアザ糖
五員環アザ糖は様々な立体配座を取りえますが、2R,3R,4S,5R-配置のアザ糖は生体を構成する代表的な糖のうちガラクトースとマンノースをミミックする配座異性体を取る可能性があります。
このようなアザ糖のβ-ガラクトシダーゼ、および、α-マンノシダーゼに対する阻害活性検討をおこなった結果、予想どおり両酵素が阻害されることが判明しました6)。また、側鎖長、環窒素のメチル基が、選択性に影響を及ぼすことも示されました。この結果は、異なる配座が酵素によって誘導されたことを示しており、創薬の場で、限られた母核構造を用いつつも、より広いターゲットを視野に入れることを可能とすると期待できます。また、化合物7は興味深いことにβ-1-4ガラクトース転移酵素の良い阻害剤(Ki=61μM, UDP-Galについて不拮抗型阻害; Km/Ki=1.54)となることが判明しました。
3.五員環アザ糖ライブラリー
先に述べたように五員環立体配座異性体を利用することで、複数酵素に対する阻害剤を開発できる可能性があります。さらに、このような化合物を母核とするコンビナトリアルライブラリーを合成することで、選択性も導くことができるかもしれません。
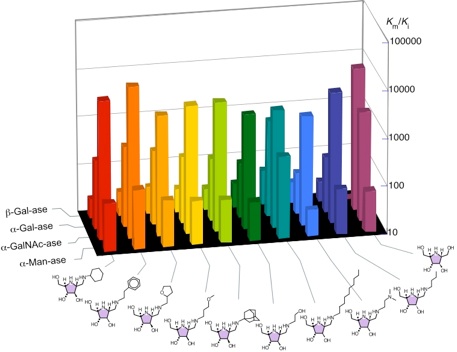
図4 「ガラクト型」アザ糖のライブラリー合成
2R,3R,4S,5R-配置のアザ糖のライブラリーから、ガラクトースミミックとマンノースミミックを見出せる可能性がある。特に導入した官能基の影響で酵素に対する選択性の向上を期待する。
ライブラリーは液相パラレル合成により行いました。アルデヒド体と9種のアミンとの還元的アミノ化反応、あるいは、ストレッカー反応を行った後、ニトリルのアミノメチル基及びアミド基への変換を行って、R1に9種の、R2に3種の置換基を導入した27種類のアザ糖ライブラリー(図4)を構築しました8)。この小さなライブラリーは、配座異性体の存在を考慮すれば「27n」化合物を含むと解釈できます。
合成したライブラリーを5種の糖加水分解酵素について阻害作用およびその酵素選択性について検討を行った結果、置換基R1により阻害の選択性に変化が起こることが判明しました。特に、R1=C10H21,R2=Hの化合物がα-マンノシダーゼの良い阻害剤(Ki=2μM)で、R1=Ph(CH2)2,R2=Hの化合物がα-N-アセチルガラクトサミニダーゼの強い阻害剤(Ki=29nM)であることが分かり、同一の母核構造の特定配座が酵素により誘導されたことを物語る結果を得ることができました。R2の置換基に関しては、本研究においては、アミノメチル基及びアミド基どちらの置換基も水素より阻害作用が減弱することが判明しました。ここで、電子供与性、吸引性の官能基の導入に対して、両者に顕著な阻害能の差異が観察されなかったことから、側鎖部分のアミノ基の塩基性は阻害能に無関係であることが推察されました。さらに、化合物7(Km/Ki=9,437)とR1=Ph(CH2)2,R2=H(Km/Ki=22,414)の化合物がα-ガラクトシダーゼ(green cofee bean)、α-N-アセチルガラクトサミニダーゼ(chicken liver)に対してそれぞれ選択性、阻害能ともに大変良好であることが判明しました。
展望
糖鎖関連酵素阻害剤の効果的開発法として立体配座を多様性領域の一因子として利用して、同時に複数の酵素に対する阻害剤の候補となりえるライブラリー合成の概念の基礎を築くことができました。今後、このような概念を基に機能的にオルソゴナルな阻害剤の開発が進めばグライコミクス研究に役立つと期待しています。
引用文献
1) M. L. Sinnott: Chem. Rev. 90, 1171-1202 (1990).
2) C. R. Rye, S. G. Withers: Curr. Opin. Chem. Biol., 4, 573-580 (2000).
3) A. Vasella, G. J. Davies, M. Bohm: Curr. Opin. Chem. Biol., 6, 619-629 (2002).
4) U. M. Unligil, J. M. Rini: Curr. Opin. Struct. Biol., 10, 510-517 (2000).
5) M. Takebayashi, S, Hiranuma, Y. Kanie, T. Kajimoto, O. Kanie, C.-H. Wong: J. Org. Chem., 64, 5280-5291 (1999).
6) C. Saotome, Y. Kanie, O. Kanie, C.-H. Wong: Bioorg. Med. Chem., 8, 2249-2261 (2000).
7) N. Asano, H. Kizu, K. Oseki, E. Tomioka, K. Matsui, M. Okamoto, M. Baba: J. Med. Chem., 38, 2349-2356 (1995).
8) C. Saotome, C.-H. Wong, O. Kanie: Chem. Biol. 8, 1061-1070 (2001).
